L'infinie longueur de l'immortalité
Laurence Ris, Pierre Gillis
Texte
La Pr. Laurence Ris est biologiste et cheffe du Service de neurosciences à l'Université de Mons (Belgique). Pierre Gillis est physicien, professeur honoraire à l'Université de Mons.
*
Pierre Gillis : La mortalité et la vie vont de pair, c’est presqu’un lieu commun. Ce thème est un des boulevards de la philosophie, mais les progrès des sciences du vivant ont suscité l’émergence d’ambitions un peu folles, ravivant des fantasmes de vie éternelle, dont les fondements se prétendent scientifiques. Il nous a paru indispensable d’éclairer notre lanterne à ce sujet, et qui mieux qu’une chercheuse dont les travaux sont à la pointe des neurosciences pouvait nous aider? Comment un être vivant pour-rait-il accéder à l’immortalité?
Laurence Ris : Théoriquement, de deux manières différentes: d’une part, en se mettant à l’abri de toutes les atteintes de l’environnement, ce qui prémunit du vieillissement, et d’autre part, en se régénérant en permanence, afin d’éliminer les organes abîmés, dans une forme de renaissance perpétuelle.
Est-ce un pur fantasme, ou bien a-t-on été chercher de l’inspiration du côté d’espèces connues?
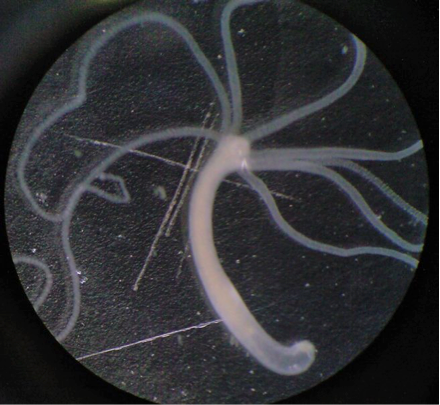
Le monde vivant est suffisamment diversifié pour fournir en modèles les amateurs de science-fiction. On connaît en effet des espèces qui ont déve-loppé l’une ou l’autre stratégie. Ainsi, quand une partie d’une hydre d’eau douce ou d’un ver planaire est hors service ou détériorée, l’organisme est capable de remplacer la pièce manquante, à partir de cellules souches. Les vers plats sont capables de « repousser » entièrement à partir d’un petit morceau : s’il subsiste un segment, le reste se reconstitue, y compris la tête, y compris leur système nerveux. On a d’ailleurs envoyé des animaux de ce type dans l’espace, afin de tester leur résistance à des conditions ex-trêmes. Certains en sont revenus avec deux têtes, signe que la régénération a parfois ses défauts.
[ V. Image 1: Hydre d’eau douce, cliquez dans l'onglet Images ci-dessus ] XX
[ V. Image 2: Ver planaire ] XX
Les espèces se perpétuent par le biais de la reproduction. La réparation pièce par pièce remplace-t-elle la reproduction?
Non, ces espèces se reproduisent. Il s’agit d’espèces hermaphrodites capables de se reproduire de manière sexuée même si elles peuvent égale-ment se reproduire par scissiparité ou bourgeonnement.
On peut se poser des questions quant à la définition d’une identité individuelle, pour des animaux qui se renouvellent morceau après morceau.
En effet. Une fois les morceaux remplacés, avons-nous encore affaire au même individu?
On peut penser à la vieille question métaphysique du couteau dont on a successivement remplacé la lame et le manche, et dont le propriétaire continue à vanter les performances tranchantes, comme il l’a toujours fait, depuis des lunes.
Bien sûr : le couteau est immortel, mais de quel couteau s’agit-il ? Qu’est-ce qui subsiste d’un individu renouvelé à ce point ? D’autres espèces rajeunissent, comme certaines méduses. Les cycles de vie de certaines espèces sont discontinus, les individus passent par des étapes intermédiaires, par exemple de type larvaire, avant de passer à une autre phase de leur développement, et finissent par mourir, après s’être reproduits. Certaines méduses ont un développement phasé, mais elles ont la particularité de revenir en arrière dans leur cycle, de le reparcourir à l’envers, pour revenir à une phase antérieure avant de repartir dans le sens « normal ». Ces méduses deviennent adultes une seconde fois, et parfois même plus de deux fois. Le second adulte du cycle est-il le même individu que le premier ? La différence par rapport au schéma reproductif, c’est qu’on ne passe pas par des cellules germinales, je serais donc plutôt en-cline à parler d’un même individu qui rajeunit, puis se remet à vieillir.
Parce qu’on ne peut pas cerner le moment clé de la naissance?
Oui, la relance du vieillissement n’est pas une naissance.
Est-ce le seul cas qui s’écarte de ce que nous considérons comme une histoire de vie au sens habituel?
On peut aussi citer les espèces dont la maturation semble sans fin, des espèces qui grandissent indéfiniment. C’est ce qui arrive aux tortues géantes et aux homards.
Indéfiniment… Vraiment sans limite?
Les tortues géantes ne vivent pas éternellement, les plus âgées ont environ 200 ans. Elles meurent parce que les risques mortels restent présents, et qu’avec le temps, elles finissent bien un jour ou l’autre par faire une mauvaise rencontre et être victimes d’un accident létal.
J’insiste cependant. Imaginons un individu protégé, qu’on maintiendrait dans un environnement sûr et sain, où on ne ferait que de bonnes rencontres. Tortue éternelle?
Il faudrait alors aussi la tenir à l’abri des radiations, des produits chimiques malfaisants, et d’autres sources d’agression cellulaire. Ces agressions sont aussi létales, à la longue. Les tortues géantes ne sont pas indes-tructibles.
En quelque sorte, leur espérance de vie intrinsèque est suffisamment longue pour qu’un événement malheureux pour leur survie se produise avant que cette limite ne soit atteinte.
On peut dire la même chose des homards : s’ils n’étaient pas pêchés, ils continueraient à grandir. On n’en connaît cependant pas qui soit devenu « millénaire », ni même qui batte les records de longévité des tortues. Mais pour un crustacé, c’est déjà pas mal!
Et pour leur croissance, pas davantage de limite?
La courbe de croissance présente une forme de saturation, la croissance ralentit, mais elle ne s’arrête pas.
Une autre stratégie est celle des tardigrades. Ce sont de petits animaux très anciens, d’une taille de l’ordre du millimètre. Leur espèce a très peu évolué, et ils résistent à un environnement insupportable – températures extrêmes, chaud ou froid, haute ou basse pression, sécheresse, excès de ra-diation – par une fuite dans le non-vivant: leur métabolisme est mis en sommeil, Ils se comportent comme certains procaryotes extrémophiles, ils glissent dans des formes cryptiques, non vivantes, et parfois pour bien longtemps, quelques années, alors que leur vie « normale » dure quelques mois, pour revenir à la vie une fois les conditions redevenues acceptables pour eux. Intéressant : c’est une piste pour des projets dont on parle de temps à autre, cryogénie notamment. On a retrouvé des tardigrades dans l’Arctique.
On peut aussi invoquer des espèces qui résistent particulièrement bien aux parasites et aux bactéries pathogènes, et qui en arrivent ainsi à prolon-ger leur vie – il ne s’agit pas d’immortalité, mais l’avantage est néanmoins notable, en termes de prolongation de la vie. On peut citer les nématodes (vers ronds), et les vers planaires. Leur système immunitaire inné est très performant, capable de lutter efficacement contre de nombreux pathogènes, y compris des organismes pathogènes pour l’homme, ce qui les rend évidemment intéressants pour le développement de stratégies théra-peutiques. Chez les nématodes, on a pu mettre en évidence deux modifications génétiques qui, lorsqu’elles sont combinées, ont pour conséquence de multiplier par 500 leur durée de vie. Dans l’hypothèse où le vieillissement est une affaire d’interaction génétique avec l’environnement, on espère jouer sur la durée de vie en modifiant ces gènes, et du même coup, les interactions avec l’environnement, plus précisément en modifiant le métabolisme et en améliorant la résistance aux pathogènes et autres facteurs de stress.
Ces nématodes vivent donc nettement plus longtemps, mais ne vieillissent-ils pas?
Il faut s’entendre sur les mots. Vieillissement et sénescence ne sont pas des synonymes: la sénescence renvoie à un état dans lequel une cellule a atteint un niveau de maturité tel qu’elle ne se divise plus. À partir de là, des mécanismes se mettent en place qui la conduisent à la fin de sa vie, on parle alors de mort cellulaire programmée ou d’apoptose. Le vieillissement est, lui, la conséquence du fait que les cellules sont attaquées en permanence, qu’elles s’en défendent par d’autres mécanismes, des mécanismes réparateurs, qui finissent par s’épuiser ou par détériorer le fonctionnement de la cellule: elle est devenue vieille. On peut observer la sénescence sur l’évolution de la peau au cours de la vie: son renouvellement se fait de plus en plus lentement.
De fait, le vieillissement est accentué par la sénes-cence, au sens où les cellules attaquées et détériorées sont de moins en moins remplacées par d’autres qui seraient engendrées par division cellulaire.
L’objectif serait alors de lutter contre la sénescence, et de rendre aux cellules la capacité de se diviser à l’infini. Ces cellules seraient immortelles, et l’organisme qu’elles forment pourrait accéder à l’immortalité si les cellules qui le constituent le sont.
On arrive en effet à cultiver des lignées de cellules qui se divisent très longtemps, par exemple pendant des mois, voire des années.
Même question que précédemment: des années, c’est sans doute long pour des cellules, mais ce n’est pas l’éternité.
La limite vient des accidents génétiques : à chaque division, le risque existe qu’une information génétique se perde, et ces pertes cumulées peuvent finir par devenir létales et mettre en cause la survie de l’organisme global.
Lors de la division, les cellules répliquent leur ADN. Notre ADN n’est pas circulaire, mais linéaire, ce qui signifie que chaque chromosome a deux extrémités, qu’on appelle les télomères. C’est souvent par les bouts de l’ADN que les problèmes surgissent, c’est le maillon faible de la division cellulaire. Or, il existe une enzyme capable de régénérer les télomères – la télomérase. Les cellules ordinaires n’ont pas de télomérase, et elles perdent un morceau de leurs télomères à chaque division, jusqu’à ce qu’elles n’arrivent plus à se diviser, elles entrent alors en sénescence ou entament le processus de vieillissement.
Qu’en est-il des cellules souches, de ce point de vue?
On parle de cellules souches pour désigner différents types de cellules. Les cellules souches totipotentes peuvent donner naissance à tous les types cellulaires et possèdent de la télomérase, elles sont donc immortelles.
Mais il existe d’autres stades de cellules souches, dites pluripotentes ; celles-ci peuvent donner naissance à plusieurs types cellulaires, mais dans un organe donné. Elles sont capables de se régénérer. On en a un peu partout dans le corps, mais certains organes plus que d’autres, de sorte qu’ils sont particulièrement aptes à se régénérer, comme le foie.
Mais ces cellules finissent quand même par voir disparaître l’enzyme qu’elles synthétisent, leur télomérase, et leurs télomères raccourcir, ce qui signe la fin de leur démultiplication.
La croissance illimitée des homards s’explique de cette manière?
Oui, toutes leurs cellules sont capables de se diviser. Pas de sénescence chez eux, ou très peu, toutes les cellules du homard contiennent de la télomérase, et la conservent pendant toute la durée de sa vie, mais cela n’empêche pas les homards de vieillir.
Dans d’autres espèces, la capacité régénérative est très élevée, c’est le cas par exemple des salamandres (axolotls) dont les membres peuvent repousser.
Les mammifères ont en général perdu cette capacité, sauf pour des organes particuliers, comme le foie.
[ V. image 3 : Une salamandre de l’espèce S. s. Terrestris, la plus répandue chez nous ] XX
A priori, cette disparition semble aller à contre-sens de l’évolution, qui favorise les mutations susceptibles de rendre les mutants plus résistants, plus aptes à survivre. Comment se fait-il que l’évolution ait favorisé cette disparition?
Il existe une théorie à ce sujet : les gènes de la sénescence sont les mêmes que ceux qui permettent le développement embryonnaire et la régulation de la croissance et de la réparation tissulaire. À la phase em-bryonnaire, l’apparition d’une spécialisation cellulaire est précisément le facteur qui empêche que se poursuive anarchiquement la croissance d’un organe arrivé à maturité, d’un organe fonctionnel. Plus l’organisme est complexe, plus son développement embryonnaire l’est, plus il nécessite de régulation et de contrôle, plus il doit être « phasé » pour arriver à faire émerger un nouveau-né doté d’une certaine autonomie. Par exemple, en ce qui concerne le système nerveux, on pourrait presque dire que sa mise en ordre de marche se fait par essais et erreurs, des cellules sont produites en trop grand nombre, et celles dont la position ou les propriétés sont inadéquates par rapport au fonctionnement systémique s’éliminent au cours du développement de l’embryon, au lieu de se reproduire et de se multiplier. La spécialisation cellulaire, qui va de pair avec un frein ou un arrêt de la division cellulaire, est nécessaire à la formation d’un organisme complexe. La morphogenèse de l’embryon est décisive.
Plus tard, lorsque le développement est terminé, le mécanisme de sénes-cence réduit les risques que fait courir à un organisme la prolifération de cellules tumorales: cette prolifération est inhibée par les gènes menant à la sénescence. La cicatrisation est aussi rendue possible de cette manière, par élimination des cellules abimées. En l’absence de contrôle de la division, les accidents de l’histoire de l’organisme ne se résorberont pas.
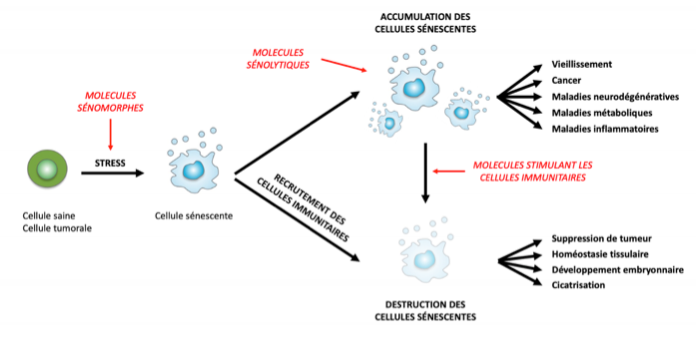
Le schéma qui suit XX s’applique aussi bien aux cellules saines qu’aux tumorales.
Pour les cellules saines, la sénescence permet le contrôle du développement et la cicatrisation ; pour les cellules tumorales (la transforma-tion tumorale résulte d’une lésion de l’ADN due à une agression cellu-laire), la sénescence permet l’élimination de la tumeur. La figure illustre bien la dualité de la sénescence: indispensable au bon déroulement de l’embryogenèse, à la cicatrisation et à la suppression des tumeurs, elle est aussi à l’origine du processus de vieillissement et de différentes patholo-gies, comme des maladies neurodégénératives, métaboliques ou inflammatoires.
[ V. image 4 - Schéma: Dualité de la sénescence ]
L’interprétation théorique que tu évoquais s’inscrit parfaitement dans l’idée philosophique d’un couplage fort entre la naissance et la mort, et même entre la vie et le mort. Il se passe des choses quand on vit, une histoire se déroule, cette histoire a un début – la naissance –, et une fin – la mort. La seule manière d’éviter la fin, c’est qu’il n’y ait pas d’histoire, qu’il ne se passe rien.
Une population mortelle, pour ne pas disparaître en tant que telle, est forcée de se reproduire. Ce n’est évidemment pas le cas d’une population immortelle. La reproduction brasse les gènes, fait émerger de nouvelles propriétés, qui elles-mêmes favorisent le prolongement de l’espèce: l’immortalité est un obstacle à l’adaptation, elle bloque l’évolution, alors que l’environnement dans lequel évolue l’espèce en question est loin d’être figé, et que de nouvelles menaces vont se manifester. D’où une situation de compétition entre deux perspectives, celle qui accroît l’espérance de vie d’un individu, et celle qui favorise son espèce: l’immortalité est certes un avantage pour un organisme, pour la durée de sa vie, mais elle n’en est pas un pour la perpétuation de l’espèce.
Le système nerveux est évidemment au centre de toutes les préoccupations, dès qu’il s’agit de comprendre les mécanismes présidant à la vie. Tous les animaux sont-ils dotés d’un système nerveux?
Revenons sur les vers plats: ils ont un système nerveux, mais pas de cerveau. Ce système nerveux est organisé en segments, c’est-à-dire qu’à chaque petit segment correspond un petit paquet de cellules nerveuses.
Indépendants es uns des autres?
Ils sont connectés entre eux, mais chaque segment a en effet son propre niveau d’organisation. Tous ces segments ne sont pas équivalents, le ver a quelque chose qui ressemble à une tête, mais son organisation est extrêmement basique. Les possibilités de régénérer un de ces segments sont donc importantes.
Ce n’est bien sûr pas le cas dans le chef d’organismes plus compliqués. En bondissant au-dessus de millions d’années d’évolution, et en s’intéressant à l’homme, on sait que sa moelle épinière est essentielle dans son système nerveux, et que les cellules nerveuses ne sont pas capables de se régénérer dans la moelle – c’est pourquoi les lésions de la moelle épi-nière causent des paraplégies ou des tétraplégies irréversibles.
Il n’y a pas de rétablissement de la motricité une fois que la moelle épinière a été coupée. En remontant l’évolution pour comprendre d’où on vient, des espèces comme les lamproies ou les axolotls disposent de cette possibilité de régénérer leur moelle épinière. Cette possibilité a disparu dans les organismes ultérieurs dans l’histoire du vivant. Pourtant, nous, humains, ne sommes pas entièrement dépourvus de cellules souches: notre peau cicatrise, elle se régénère. Il existe même des cellules souches dans le système nerveux. Mais ces cellules ne permettent pas la régénération du tissu nerveux, au contraire, elles inhibent la croissance neuronale en formant une cicatrice au niveau de la lésion XX.
S’agit-il d’une évolution régressive, d’un contre-exemple à la règle générale?
Pas sûr. D’une part, même en cas de « réparation » de la moelle à la suite d’une lésion, celle-ci ne serait sans doute pas assez rapide pour que la victime d’un accident échappe à ses prédateurs. Mais au-delà de cet argument peut-être simpliste, il semble qu’en cas de repousse de la moelle, celle-ci se produise un peu n’importe comment, au sens où les connexions ne retrouvent pas exactement leur place antérieure. Ce n’est pas la même chose pour un nerf: celui-ci est contenu dans une gaine, qui canalise la re-pousse et la guide. La moelle a une organisation complexe, et une éventuelle repousse n’est pas contrainte par une gaine, elle peut se faire anar-chiquement et déboucher sur des problèmes fonctionnels insurmontables. C’est d’autant plus le cas que l’organisme est compliqué, et que ses neu-rones sont spécialisés, y compris dans leurs connexions, cruciales pour que le système nerveux soit performant.
Ce constat explique le sens de l’évolution, mais on comprend aisément qu’il conditionne également les tentatives thérapeutiques.
La recherche se concentre pour le moment sur des tentatives de restaurer la motricité en reconnectant les zones intactes aux nerfs et aux muscles. Mais on est loin de reconstituer le système complet: il ne s’agit là que de la fin de la transmission nerveuse, et de la possibilité de remobiliser un muscle. Ce n’est pas rien, évidemment, mais ce n’est pas de la reconstitution d’un système complet et fonctionnel qu’il est question. C’est encore plus difficile chez un adulte que chez un enfant: chez un enfant, les con-nexions se mettent en place, le système est encore souple, alors que chez un adulte, cette mise en place est achevée, et le système est devenu plus rigide. Les réseaux neuronaux chez les mammifères sont d’une énorme complexité, et plus le système est complexe, plus il est difficile à réparer: dans notre moelle, on recense une centaine de types de neurones différents.
Il est donc difficile de pousser bien loin les possibilités de régénérations d’organes.
On vient de discuter ce que cela représente pour la moelle épinière. En posant la question pour le cerveau, on plonge au cœur de la personnalité d’un individu. Un nouveau-né n’a pas encore vraiment de personnalité. Cette personnalité se construit avec la mise en place des connexions entre neurones : il ne faut pas s’y tromper, il est absurde de vouloir localiser la personnalité de quelqu’un dans une zone de son cerveau. C’est l’ensemble qui est concerné, via l’interaction entre les cellules, et celles-ci se mettent en place avec le temps, cela dure des années. C’est une erreur de croire qu’il existe un ensemble, un paquet de neurones porteurs de la personnalité.
Dans un réseau complexe, l’introduction d’une nouvelle cellule ne se fait pas poste pour poste, comme on dit dans le monde du football : la nou-velle venue doit établir ses connexions avec ses partenaires, elle ne va pas agir à l’identique de ce que faisait celle qu’elle est supposée remplacer. La nouvelle remplira ses fonctions basiques comme les cellules du même type le font, et tant qu’on s’en tient à des formes de perception relativement passive, ça peut marcher, mais son rôle dans le réseau ne se résume pas à ces fonctions basiques: ce qui débouche sur la perception du monde, sur la mémoire, sur la constitution de la personnalité, tout cela dépend fortement des connexions et des interactions avec le restant du réseau.
Certaines réparations par « remplacement » de neurones s’avèrent possibles, pour des fonctions sensorielles simples, comme la sensibilité au toucher, mais même ces circuits simples ne fonctionnent qu’après un temps relativement long d’apprentissage.
Croire qu’après avoir remplacé des neurones morts par d’autres vivants, on se retrouve face à la même personne qu’avant remplacement, c’est un leurre. L’histoire d’un individu est écrite dans ses connexions neuronales, et si on les remplace, on change tout – jusqu’à la conscience de la personne qu’il ou elle est.
Le film de David Fincher, L’étrange histoire de Benjamin Button (2008), est une drôle d’illustration de la construction d’une personnalité sur une durée de vie – sauf qu’elle se déroule à l’envers, en remontant le temps.
Le personnage joué par Brad Pitt vieillit en reparcourant sa vie à l’envers, en retournant vers sa jeunesse et son enfance : il vieillit en rajeu-nissant. Pourtant, il se crée progressivement des souvenirs, alors que le scénario poussé au bout de sa logique aurait dû l’amener à perdre ses souvenirs lorsqu’il retourne vers son enfance. Ce n’est pas le cas, alors qu’en fin de vie, redevenu poupon, il perd l’usage de la parole. On touche les limites de la cohérence d’un scénario de science-fiction!
La sénescence est liée à la fin du processus de division cellulaire, disais-tu. Dans le système nerveux, cette fin est particulièrement rapide, comparée à la durée de vie globale.
Il existe quelques foyers de cellules souches dans le cerveau, présentes depuis la phase embryonnaire, qui se multiplient et viennent s’intégrer dans les réseaux olfactifs, et de l’hippocampe. Quand elles s’insèrent dans les réseaux qui pilotent la mémoire, on pense que ce sont elles qui permet-tent d’enregistrer de nouvelles données, liées à un nouvel environnement, par exemple. Elles ne fonctionnent pas sur le modèle de la table rase, mais elles intègrent les nouveautés, et enrichissent ainsi le fonctionnement du réseau : de nouvelles cellules pour de nouvelles tâches.
On en arrive donc à l’idée qu’il est plus intéressant de lutter contre le vieillissement que d’essayer d’éliminer la sénescence, puisque celle-ci est intrinsèquement liée à l’existence de mécanismes complexes et spécialisés.
Oui, les stratégies pour prolonger la vie doivent jouer sur le vieillissement en tant que tel plutôt que sur la sénescence, mais pour être efficaces, elles devraient être mises en place dès le début de la sénescence, soit dès l’adolescence, et même encore un peu plus tôt pour le système nerveux, mature plus précocement. L’objectif serait de protéger nos cellules de toutes les agressions imaginables, chimiques, toxiques, irradiantes, stres-santes, et on a alors toutes les chances de vivre nettement plus longtemps qu’autrement.
*
On en vient à la question que j’aurais peut-être dû poser avant toutes les autres: pourquoi vouloir vivre beaucoup plus longtemps? Il me semble clair que les motivations les plus répandues tiennent à des ego hypertrophiés, chez des personnes qui n’imaginent pas le monde sans eux.
Ou tout simplement par le refus de terminer une vie qu’on trouve agréable… Du point de vue de l’espèce humaine, les choses sont bien dif-férentes : survie individuelle et perpétuation de l’espèce pourraient entrer en compétition. Des simulations ont illustré l’issue de cette compétition: elles ont montré qu’une espèce humaine mortelle peut espérer un avenir plus long qu’une espèce humaine immortelle. En restant toutefois dans le cadre par définition fini des possibilités offertes aux simulations: il faut entendre ici « immortel » comme bénéficiant d’une belle prolongation de la durée de sa vie, plutôt que d’un accès à l’éternité, ou de renaissances infiniment renouvelées.
On peut comprendre: l’immortalité débouche sur une existence plate, lisse, même pas un long fleuve tranquille. Mais l’univers n’est pas immuable, et l’état figé de l’immortalité hypothèque et annihile les adapta-tions indispensables, ce qui est sans doute le sens profond des conclu-sions des simulations.
En effet, l’homme n’est pas isolé, il faut le penser dans son environnement, et les contraintes que cet environnement exerce sont très fortes. Les moyens de son adaptation manqueront nécessairement à une espèce immortelle. Ainsi, si le virus COV19 était plus mortel (comme Ebola), les seules personnes qui pourraient survivre seraient celles qui n’expriment pas, ou peu, le récepteur qui permet au virus d’entrer dans les cellules (ACE2) ou qui expriment une forme légèrement modifiée du récepteur qui ne serait plus reconnu par le virus (différence due à des mutations aléatoi-res).
Dans l’histoire de l’humanité, la pression de l’environnement s’est surtout marquée par la disponibilité des vitamines (molécules essentielles à la vie mais non produites par l’homme).
C’est ainsi que la couleur de la peau a évolué différemment dans différentes parties du globe, les peaux les plus claires étant mieux adaptées aux régions peu exposées aux UV.
Aujourd’hui, c’est moins le cas, car on apporte ces vitamines dans l’alimentation ou encore en gélules, mais imaginons que la couche d’ozone diminue: les radiations UV augmenteraient très fort et les UVC arriveraient sur terre. Seuls les organismes capables de se protéger des UVC pourraient survivre (extinction de masse à prévoir!)
Le moyen le plus sûr d’échapper à toutes les agressions du monde extérieur, c’est de passer sa vie au lit, sans jamais s’exposer au soleil, de se nourrir via un tuyau, de prendre des vitamines, de ne voir personne…
Sans caricaturer, les attitudes adoptées par les personnes attentives à la qualité de leur environnement, de leur nutrition – on ne boit pas trop, on ne fume pas trop, etc. – se comportent un peu en appliquant de tels préceptes.
Se préoccuper de son hygiène de vie, c’est évidemment mieux pour sa santé que de vivre dans l’excès systématique, mais les données existent déjà pour voir ce que ça donne: l’effet est mesurable et réel, sans aucun doute, mais loin des ambitions de ceux qui parlent de doubler ou tripler notre durée de vie.XX
En effet, on n’ira pas très loin de cette manière. Les centenaires restent rares.
Et la plupart d’entre eux portent lourdement leur âge. N’entend-on pas parler de stratégie plus radicale que celle qui consiste à vivre prudemment?
Sans intervention, je n’en vois pas.
Et avec intervention?
Thérapie génique ? On pourrait imaginer, au-delà de toute considération éthique, d’intervenir sur des embryons pour procéder à des modifications génétiques susceptibles de prolonger la vie: on pratique déjà des modifications génétiques pour guérir une maladie ; autre chose serait d’en pratiquer pour prévenir l’apparition d’une maladie dont on ne souffre pas, et finalement, on irait encore un cran plus loin en se fixant pour objectif de prolonger la vie, sans viser une maladie précise…
Alors que ces interventions génétiques sont pensées avec un objectif défini, on n’est jamais certain que d’autres effets non prévus ne vont pas se déclarer.
En effet. Les interventions génétiques se traduisent presque toujours par des effets qui n’ont pas été pensés au départ, et qui n’ont pas grand chose à voir avec l’objectif visé. Chez les souris transgéniques par exemple, on observe régulièrement une diminution de la capacité reproductive, un changement du métabolisme retardant la croissance, parfois l’apparition de masses tumorales, un comportement stéréotypé, une queue malformée, etc. Encore une fois, le système réagit comme un tout, et c’est ce tout qui est affecté par la modification. On rejoint là l’idée directrice de la compréhen-sion des mécanismes de l’évolution.
Et pour garder la jeunesse éternelle, pourrait-on remplacer un-à-un les organes?
Pour le cerveau, une idée serait de reproduire l’ensemble des connexions neuronales dans un ordinateur soit pour y vivre virtuellement éternellement, soit pour pouvoir retransférer ces données dans un cerveau jeune.
Comment, cela reste de l’ordre du mystère, dans la mesure où la restau-ration de toutes les connexions antérieures n’est pas possible. Il existe un projet européen (Human Brain Project, HBP) qui est parvenu à complètement modéliser un mm3 de cerveau de souris, en prenant en compte toutes les connexions entre tous les neurones qui s’y trouvent. Le cerveau com-plet de la souris a un volume d’environ un cm3, soit mille fois plus.
C’est un travail impressionnant qui a mobilisé d’énormes ressources informa-tiques et humaines, et c’est censé être le premier pas d’une entreprise de modélisation du cerveau humain. À mon sens, elle se heurte à une objection majeure: le cerveau humain est une machinerie mouvante, il n’est pas rigide, les connexions vont et viennent – on n’a d’ailleurs toujours pas bien compris comment est organisé le support matériel de la mémoire.
On sait d’ailleurs bien qu’en cas d’accident cérébral portant atteinte à une région où était localisée une tâche précise, il arrive fréquemment qu’un nouvel apprentissage débouche sur la prise en charge de la fonc-tion par une autre région du cerveau que celle, lésée, qui l’assurait auparavant.
C’est en effet une preuve du fait que le cerveau n’est pas figé dans son organisation interne, dans ses connexions. C’est ce que je veux dire en rappelant que la manière dont la mémoire est fixée n’est pas bien com-prise : les connexions se modifient continûment, mais l’information se maintient. Il me semble que la compréhension de ce paradoxe est un préalable pour une modélisation réaliste du cerveau. Il arrive que des patients présentent un trouble de la personnalité, et que l’apport d’un seul type de molécule mette fin à ce trouble. Cette molécule n’agit pas strictement localement, elle agit un peu partout dans le cerveau, ce qui confirme l’idée de l’importance de la délocalisation de l’origine du symptôme observé.
On touche du doigt, avec cet exemple, ce que Patrick Tort appelle les excès du réductionnisme – un tout peut être porteur de propriétés dont ses parties constituantes sont dépourvues. XX
Une autre manière d’admettre que quelque chose manque, c’est le contraste entre le volume des machines informatiques nécessaires pour analy-ser et reproduire le fonctionnement du cerveau et celui, considérablement moindre, du cerveau lui-même. Sans parler de la consommation d’énergie qui va de pair !
On imagine peut-être plus facilement des échanges standard pour d’autres organes que le cerveau.
J’ai envie de poser le problème en repartant du cerveau. Un cerveau ne fonctionne pas pour lui-même, en circuit fermé. Si on le coupe de ses en-trées sensorielles, il est plus que mutilé: on peut le maintenir en vie en tant qu’organe isolé, mais il aura perdu l’essentiel de ses merveilleuses capacités, celle de réfléchir, celle de cristalliser une personnalité, celle de s’adapter à un environnement.
Il ne se contente pas non plus de traiter les stimulations sensorielles auxquelles il réagit: ce qu’il produit, ses outputs, sont aussi importants pour lui ; s’il se retrouve coupé des organes qu’il commande et par lesquels il interagit avec son extérieur, il va se réorganiser, et, encore une fois, se transformer profondément.
Et un cerveau qui n’aurait jamais été soumis aux stimuli que reçoit le cerveau d’un individu « normal » différerait rapidement et profondément d’un cerveau « normal».
Certains organes sont-ils plus faciles à remplacer?
En général, tous ceux qui sont constitués par des répétitions d’unités indépendantes – le foie, par exemple, ou le rein. Ce sont d’ailleurs ces organes qui sont capables de se régénérer.
Le cœur, c’est déjà plus compliqué, parce que son fonctionnement implique une synchronisation précise d’actions successivement exercées par certaines de ses parties, par le biais d’interventions musculaires commandées par des influx électriques. Les parties du cœur doivent fonctionner en harmonie et de manière synchrone. Cependant, le développement de cœurs artificiels semble prometteur.
Pour les poumons, leur substitution par une machine intracorporelle n’est actuellement pas envisagée mais des organes recréés en laboratoire pourraient être greffés à la place d’organes déficients, avec tous les risques que ce type d’opération comporte. On implanterait un poumon biosynthétique, fabriqué grâce à une espèce d’échafaudage protéique, créé à partir de matériaux provenant des poumons d’où ont élé éliminées les cellules pour n’y laisser que des protéines. Ce support serait ensuite nourri en laboratoire et enrichi de cellules pulmonaires provenant de l’individu à greffer, un cochon dans l’expérience effectuée XX.
Dans ce cas, le risque de rejet est limité car on utilise les cellules du patient.
L’échafaudage protéique étranger sert pour la mise en place des cellules, mais celles-ci vont ensuite resynthétiser leurs propres protéines (dont la durée de vie est limitée).
Au-delà d’un éventuel rejet, les risques sont liés à la chirurgie, aux infections, aux hémorragies, au mauvais fonctionnement de l’organe implanté, etc.
Pour l’intestin, on pense à des régénérations du tissu à partir de cellules souches, mais la recherche sur ce sujet doit encore progresser. C’est un organe plus complexe que ce qu’on imagine parfois, ce n’est pas un simple tuyau, sa paroi n’est pas imperméable et il est richement innervé.
Si je t’entends bien, c’est plutôt un certain scepticisme qui domine chez toi…
Notre façon de vivre intègre la naissance et la mort. À titre personnel, si on m’apprenait tout à coup que j’ai encore 500 ans à vivre, je me demande ce que je ferais de ces 500 ans. Mon travail m’intéresse et me passionne, et me dire que je vais le poursuivre encore pendant une vingtaine d’années ne me fait pas peur – mais 500 ans ? Je devrais trouver autre chose à faire à intervalles réguliers, tous les 10 ans, sans doute…
En supposant le maintien des capacités nécessaires pour ces reconversions successives…
Oui, il faudrait être immortel et jeune simultanément. Voir évoluer mes enfants a une énorme importance pour moi, les voir se former et les suivre en contribuant à leur évolution, c’est une raison de vivre. On est privé de ces joies quand par malheur, on est confronté à un enfant handicapé, qui n’évolue pas, quand bien même il peut être heureux. On mesure de la sorte à quel point il est douloureux de voir un proche bloqué dans un état de vie qui n’est pas évolutif. C’est la situation dans laquelle nous plongerait l’immortalité: rien d’évolutif. Je ne sais pas comment je pourrais gérer une telle situation.
Encore faut-il avoir envie de devoir la gérer.
Bien sûr: j’ai plus de problèmes avec l’idée d’une existence où plus rien ne se produit, plate et lisse, mortellement triste, qu’avec l’idée du vieillissement et de la mort, qui sont le revers de la vie. La vie est importante et positive par ce qu’on en fait, et par ce qu’on a envie d’en faire tant qu’on est là.
© Laurence Ris, Pierre Gillis, revue Les Cahiers internationaux du Symbolisme n° 155-156-57, 2020.
Notes
- https://fr.wikipedia.org/wiki/Hydre_(zoologie)#/media/Fichier:Hydra001.jpg
- https://commons.wikimedia.org/wiki/File:Dugesia-gonocephala-01-fws.jpg
- https://commons.wikimedia.org/wiki/File:Feuersalamander_im_Harz_2014.jpg#file
- Figure extraite de Pierre-François Roux et Oliver Bischof, « La sénescence, une destinée cellulaire aux multiples visages », Planet Vie, publié le 14/03/19, sur le site https://planet-vie.ens.fr/thematiques/cellules-et-molecules/physiologie-cellulaire/la-senescence-une-destinee-cellulaire-aux
- En thérapie, on n’implante pas les cellules sous forme de cellules souches, sinon elles pourraient devenir n’importe quoi. On implante des cellules qui ont entamé le processus de différenciation, c’est-à-dire dont la destinée a été scellée, on leur a « appris à se suicider » (Cf. Kheira Bettayeb et Jean-Baptiste Veyrieras, « Le Corps régénéré », dans Sciences & Vie, n° 1236, septembre 2020, pp. 64-81). En faisant cela, on enclenche en même temps le processus de sénescence
- Voire plus: en décembre 2018, le journal français en ligne « 20 minutes » a interviewé Aubrey de Grey, ancien informaticien reconverti dans la biologie, et promoteur de SENS (Strategies for Engineered Negligible Senescence), une fondation à but non lucratif qui pilote des programmes de recherche pour combattre la vieillesse et à laquelle il a consacré une grande partie de sa fortune (voir le site https://www.20minutes.fr/arts-stars/culture/2400047-20181220-aubrey-grey-vingt-ans-pourrons-esperer-vivre-centaines-milliers-annees). De Grey y a déclaré : « Dans vingt ans, il est possible – pas certain, mais possible – que nous puissions vivre des centaines ou des milliers d’années. »
- Patrick Tort, Qu’est-ce que le matérialisme ? Introduction à l’Analyse des complexes discursifs. Paris, Éditions Belin, 2016
- https://www.futura-sciences.com/sante/actualites/medecine-poumons-artificiels-transplantation-reussie-chez-cochon-52428/
Images